Contexte et méthodologie de l'étude
Le rétatrutide (LY3437943) est un nouveau médicament mono-peptidique qui activetrois récepteurs simultanémentGIP, GLP-1 et glucagon. Afin d'évaluer son efficacité et son innocuité chez les personnes obèses non diabétiques, un essai de phase 2, randomisé, en double aveugle et contrôlé par placebo a été mené (NCT04881760). Au total,338 participantsLes patients ayant un IMC ≥ 30, ou ≥ 27 avec au moins une comorbidité liée au poids, ont été randomisés pour recevoir un placebo ou du rétatrutide (1 mg, 4 mg avec deux schémas de titration, 8 mg avec deux schémas de titration ou 12 mg) administré une fois par semaine par injection sous-cutanée pendant 48 semaines.critère d'évaluation principalétait le changement en pourcentage du poids corporel à 24 semaines, avec des critères d'évaluation secondaires incluant le changement de poids à 48 semaines et des seuils de perte de poids catégoriels (≥5%, ≥10%, ≥15%).
Principaux résultats
-
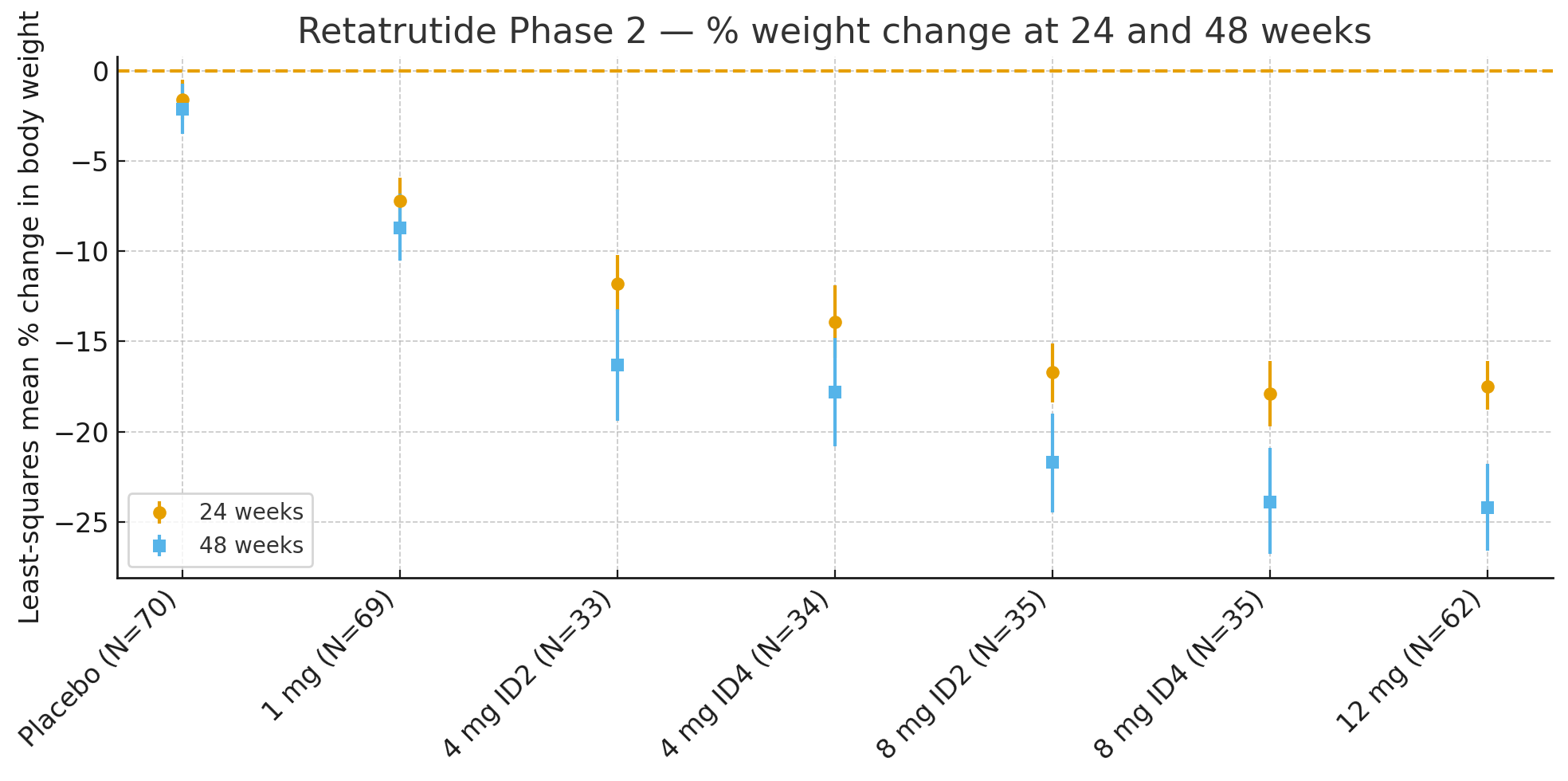
24 semainesLa variation moyenne en pourcentage du poids corporel par rapport à la valeur initiale, calculée par la méthode des moindres carrés, était de :
-
Placebo : −1,6 %
-
1 mg : −7,2 %
-
4 mg (combinés) : −12,9 %
-
8 mg (combinés) : −17,3 %
-
12 mg : −17,5 %
-
-
48 semaines: Le pourcentage de variation du poids corporel était
-
Placebo : −2,1 %
-
1 mg : −8,7 %
-
4 mg (combinés) : −17,1 %
-
8 mg (combinés) : −22,8 %
-
12 mg : −24,2 %
-
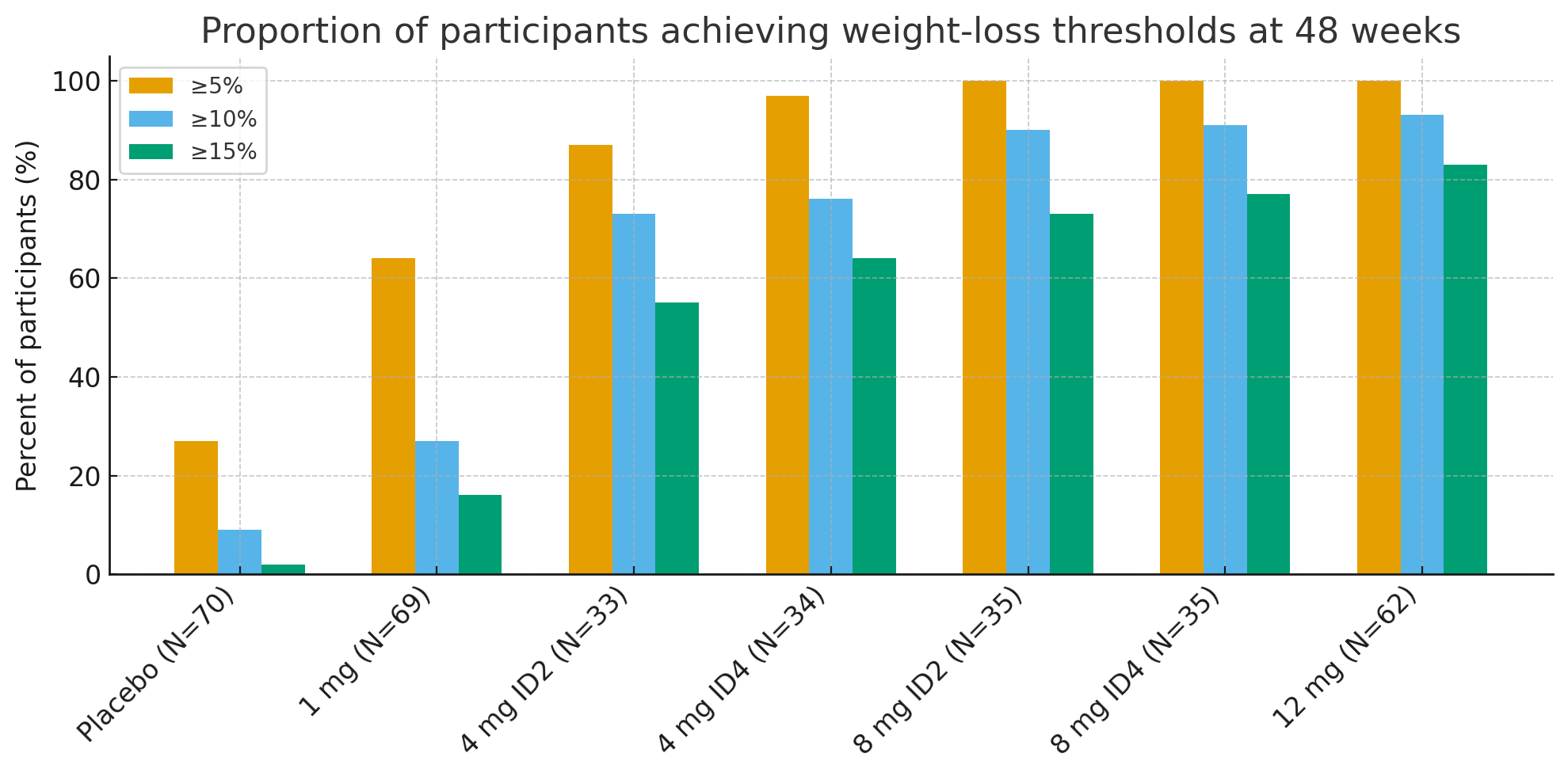
À 48 semaines, les proportions de participants atteignant des seuils de perte de poids cliniquement significatifs étaient frappantes :
-
Perte de poids ≥ 5 % : 27 % avec le placebo contre 92 à 100 % dans les groupes actifs
-
≥10 % : 9 % avec le placebo contre 73 à 93 % dans les groupes actifs
-
≥15 % : 2 % avec le placebo contre 55 à 83 % dans les groupes actifs
Dans le groupe de 12 mg, jusqu'à26 % des participants ont perdu ≥ 30 % de leur poids initial, une perte de poids d'une ampleur comparable à celle d'une chirurgie bariatrique.
Sécurité
Les effets indésirables les plus fréquents étaient d'ordre gastro-intestinal (nausées, vomissements, diarrhée), généralement d'intensité légère à modérée et dose-dépendants. L'administration de doses initiales plus faibles (titration à 2 mg) a permis de réduire ces effets. Une augmentation de la fréquence cardiaque dose-dépendante a été observée, avec un pic à la semaine 24, suivie d'une diminution. Les taux d'arrêt de traitement variaient de 6 à 16 % dans les groupes traités, soit un taux légèrement supérieur à celui observé sous placebo.
Conclusions
Chez les adultes obèses non diabétiques, l'administration hebdomadaire de rétatrutide par voie sous-cutanée pendant 48 semaines a produitréductions substantielles et dose-dépendantes du poids corporel(jusqu'à une perte moyenne d'environ 24 % à la dose la plus élevée), ainsi que des améliorations des marqueurs cardiométaboliques. Les effets indésirables gastro-intestinaux étaient fréquents mais gérables par titration. Ces résultats de phase 2 suggèrent que le retatrutide pourrait constituer une nouvelle référence thérapeutique pour l'obésité, sous réserve de confirmation par des essais de phase 3 de plus grande envergure et à long terme.
Date de publication : 28 septembre 2025